03/04/2019 - Equipe Target
NBR ISO 1135-4 de 11/2014: os requisitos para os equipos de transfusão de uso único
Confirmada em 03/2019, a NBR ISO 1135-4 de 11/2014 - Equipamentos de transfusão para uso médico - Parte 4: Equipos de transfusão para uso único especifica os requisitos para os equipos de transfusão de uso único para uso médico, de modo a garantir sua compatibilidade com as bolsas de sangue e seus componentes, e com os equipamentos intravenosos. Os objetivos secundários desta parte da NBR ISO 1135 são proporcionar a orientação sobre as especificações relacionadas à qualidade e ao desempenho dos materiais utilizados nos equipos de transfusão e apresentar as designações para os componentes dos equipos de transfusão. Em alguns países, a farmacopeia nacional ou outros regulamentos nacionais estão legalmente vinculados e têm prioridade sobre esta parte da NBR ISO 1135.
Target Genius Respostas Diretas:Como deve ser feita a avaliação da contaminação por partículas?
Como devem ser feitos os ensaios de eficiência do filtro para sangue e hemocomponentes?
Como deve ser executado o ensaio do injetor lateral?
Como deve ser realizado o ensaio de absorbância?
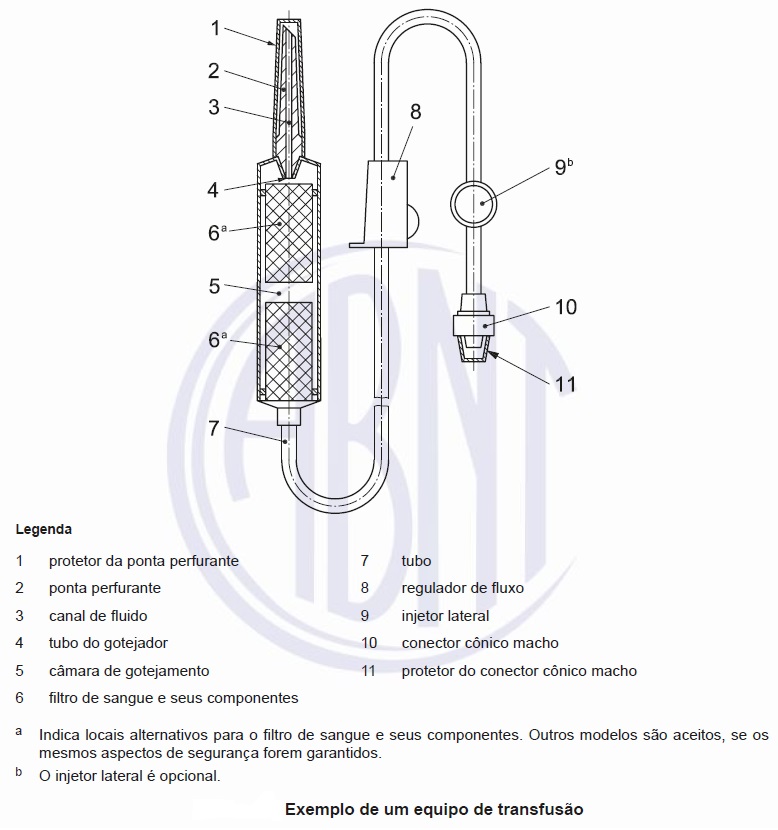
A nomenclatura para os componentes de equipos de transfusão é dada na figura abaixo:
Clique na imagem acima para uma melhor visualização
Um equipo de transfusão em conformidade com os requisitos desta parte da NBR ISO 1135 é designado da seguinte forma: Equipo de transfusão NBR ISO 1135-4. Os materiais utilizados na fabricação dos equipos de transfusão mencionados na Seção 3 devem estar em conformidade com os requisitos especificados na Seção 5.
Caso os componentes do equipo de transfusão entrem em contato com o sangue e seus componentes, eles adicionalment...